Koen Reesink, UD bij de vakgroep Biomedical Engineering van Maastricht UMC, heeft voor het Cellsystemics-project een publiek-privaat consortium opgezet.
Onlangs is het Cellsystemics-project van start gegaan. Hiervoor is onder leiding van initiator en coördinator Koen Reesink, UD bij de vakgroep Biomedical Engineering van Maastricht UMC, een publiek-privaat consortium opgezet. Het in het kader van het programma Humane Meetmodellen gefinancierde project heeft als doel om kwantitatief inzicht te krijgen in de complexe onderlinge verbanden tussen biomechanische, biochemische en mechanobiologische mechanismen die ten grondslag liggen aan vaatweefselziektes waarbij de wisselwerking tussen gladde spiercellen en het omliggende weefselnetwerk is verstoord. Denk daarbij aan aderververkalking en aneurysmavorming.
Dynamisch systeemgedrag van gladde spiercellen onder de loep voor beter begrip vaatziektes

Bij de vakgroep Biochemie wordt de Cytation 3 ingezet voor onder meer verkalkingsassays.
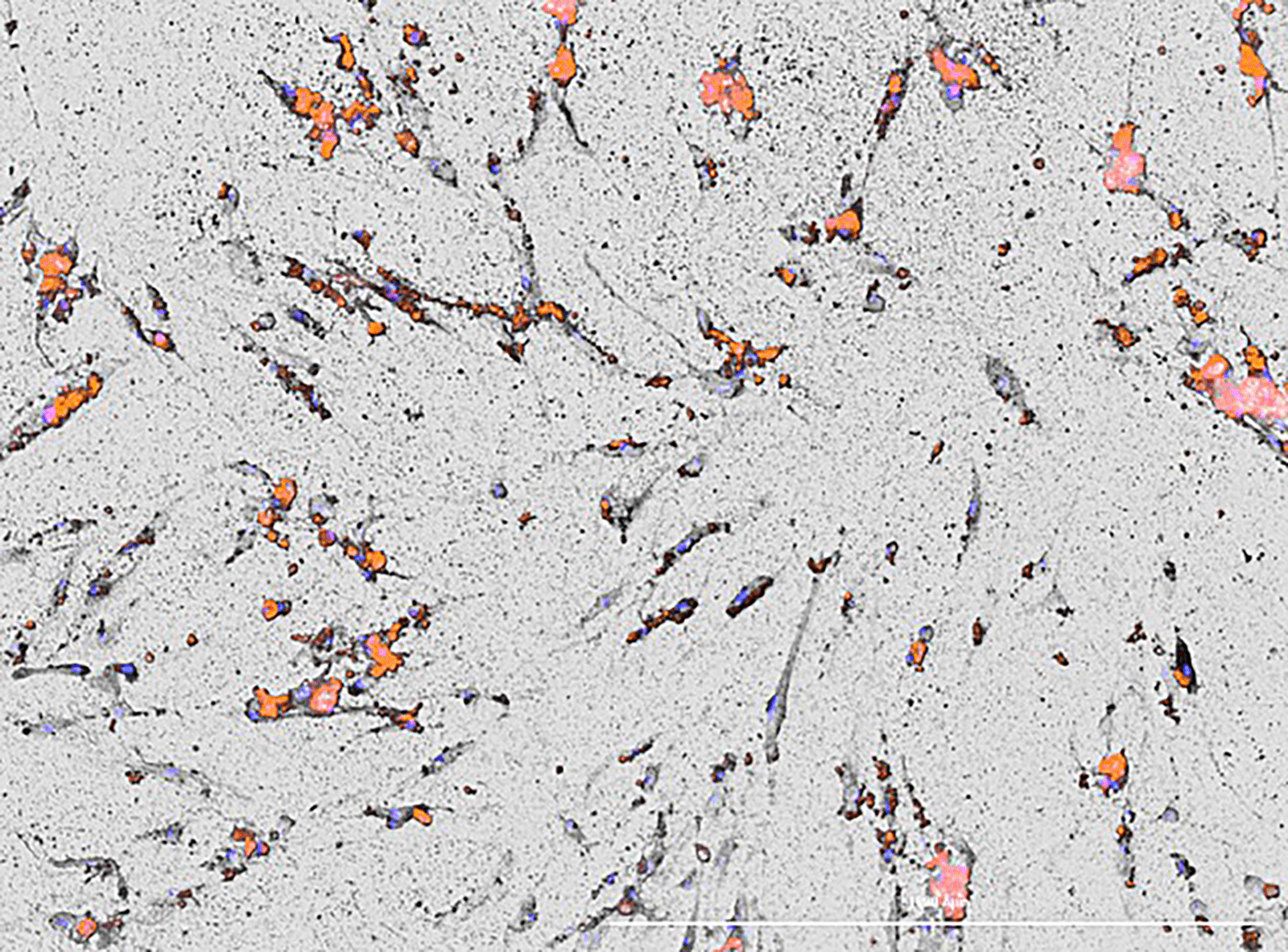
De biochemische karakterisering van de vasculaire gladde spiercellen (VSMC’s) vindt nu plaats met de Cytation 3.
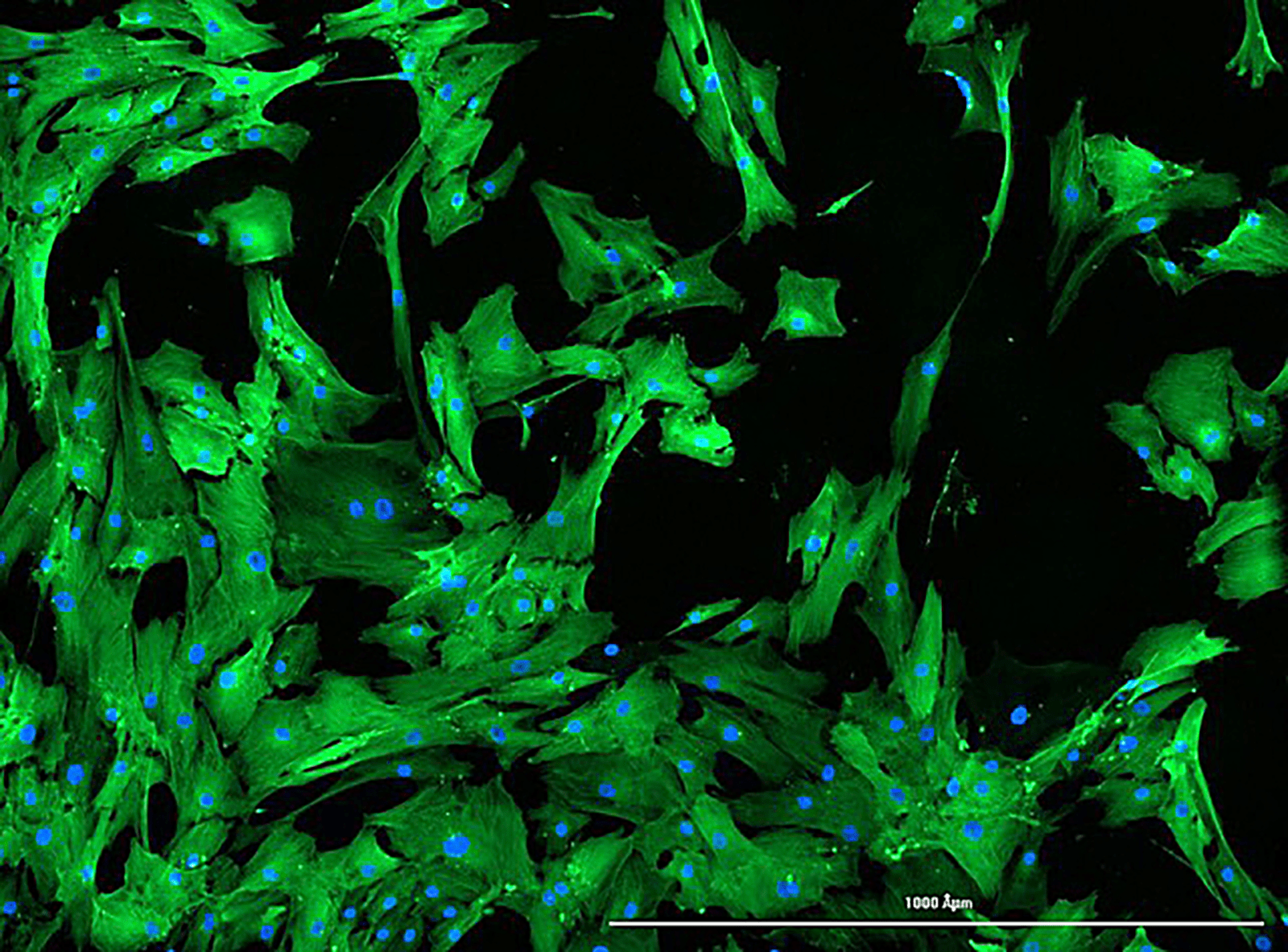
Koen Reesink en Armand Jaminon bij de Cytation 3 van BioSPX. Dit instrument, of zijn beoogde opvolger Cytation C10, zal ook worden ingezet bij het Cellsystemics-project.

Om goed te begrijpen hoe de cel functioneert zullen we meetexperimenten opzetten die qua in- en output een stuk verder gaan dan de gangbare.


We kijken niet alleen naar de cel, maar ook naar zijn omgeving.
Who is who bij Cellsystemics?
- Optics11 Life (indendatie-apparatuur)
- Confocal.NL (confocale imaging)
- HCM Medical (technologie om cellen uit weefsel te halen en dat weefsel vrij intact weer terug te geven)
- BioSPX (gebruikersperspectief, imaging en software)
Initiator en coördinator is Koen Reesink, UD bij de vakgroep Biomedical Engineering van de CARIM onderzoeksschool voor Cardiovasculaire Ziektes, van Maastricht UMC. In het project zitten nog twee vakgroepen van CARIM waarmee binnen het MUMC al intensief wordt samengewerkt, te weten Biochemie en Cardiothoracale Chirurgie. Vanuit de TU/e participeert de vakgroep Control Systems van de faculteit Elektrotechniek.
Verdere consortiumpartners zijn:
- STEMCELL Technologies (media voor celkweek)
- Contactgroep Marfan Nederland, de Nederlandse patiëntenvereniging voor bindweefselziektes, en dan met name de genetische aandoeningen
Hogere wiskunde
“Om goed te begrijpen hoe de cel functioneert zullen we meetexperimenten opzetten die qua in- en output een stuk verder gaan dan de gangbare, waarbij je –simpel gesteld– kijkt naar één eigenschap van de cel, er iets opgooit en dan kijkt naar het effect. Dat is één meetpunt in de tijd. Om de cel goed uit te lezen willen we, naar analogie van een elektronisch circuit, de cellen ‘doorfluiten’: zoveel mogelijk in- en uitgangen uitlezen. Je hebt alle mogelijke stimuli met verschillende sterktes en meerdere tijdspunten nodig om vat te krijgen op de complexe dynamica van de regelsystemen in en rondom de cel”, vertelt Koen.
Met die enorme veelheid van signalen en data gaan de ingenieurs van de Control Systems groep van de TU/e aan de slag. Onder de noemer systeemidentificatie brengen ze alle gegevens tot een model aan de hand waarvan betrouwbare, reproduceerbare voorspellingen kunnen worden gedaan. “Het project duurt vier jaar, en het is voor mij nu lastig om te voorspellen hoe ver we gaan komen. Maar als we tot zo’n model komen, dan zouden we in de klinische praktijk aan prognostiek kunnen gaan doen. Door in een veel vroeger stadium dan nu een buisje bloed af te nemen van iemand, kan je dan het ziekteverloop voorspellen, voor zowel mensen mét als mensen zonder een erfelijke belasting. Patiënten zijn gebaat bij meer duidelijkeid over het verloop van hun ziekte. Als we iets van die onzekerheid kunnen wegnemen, is wat mij betreft het project geslaagd.”
Karakterisering cellen
Binnen CARIM zijn nog twee deelnemers aan het Cellsystemics-project, te weten de vakgroepen Cardiothoracale Chirurgie en Biochemie, die uiteraard ook de nodige expertise inbrengen. Wat betreft Biochemie is dat onder meer kennis van de biologie van de gladde spiercel en de uitgebreide expertise in het karakteriseren van de cellen. Op dat gebied is ook de jarenlange relatie met consortiumpartner BioSPX relevant, stelt post-doc Armand Jaminon. “Wij gebruiken bij Biochemie al sinds 2015 de Cytation 3, een plate reader met imaging functie. Wij denken dat de BioSPX-apparatuur prima geschikt is voor het project, al hebben we dan wel een voorkeur voor de modernere Cytation C10. In een demo van dit systeem kwam duidelijk de toegevoegde waarde naar voren van de confocale functie in de vorm van een hogere resolutie. Ook is er een lagere achtergrondruis, heb je veel scherpere beelden en kan je grotere vergrotingen realiseren. Wij kijken hiermee vooral naar fluorescentie, omdat we specifieke moleculen in de mechanobiologie willen aankleuren, zodat je die structuren visueel kunt maken.
Een andere reden om BioSPX bij het project te betrekken is hun marktkennis. “We kunnen in de komende jaren wel een mooi platform ontwikkelen, maar is dat dan alleen voor ons onderzoek, of kunnen andere groepen er ook van profiteren? De kans daarop kan je vergroten door bepaalde features standaard in de software in te bouwen, die het gebruik vergemakkelijken en doelgerichter maken. Van die praktijk maken wijzelf ook al jaren gebruik in de relatie met BioSPX, dat in die zin fungeert als de ogen en oren van Agilent, de fabrikant van de Cytation-apparatuur. De sales engineers van BioSPX luisteren goed naar onze wensen, en brengen die over naar Agilent. Die zien we regelmatig terug in de vorm van nieuwe functies en updates, of ze wijzen ons op een oplossing die al voorhanden is. Wij kennen ook niet alle ins-and-outs van zo’n apparaat!”, lacht Armand.


Een belangrijke doelstelling van het project is om te komen tot een meetsysteem waarin zowel mechanische als biologische parameters worden gemeten, en dan niet alleen op cel- maar ook op systeemniveau. Een dergelijk systeem, dat nog niet bestaat, zal met hulp van drie van de zes consortiumpartners worden ontwikkeld, met name Optics11 Life, Confocal.nl en BioSPX.
Optics11 Life ontwikkelt apparatuur voor zogenaamde indentatietesten, waarbij kleine krachten en/of kleine verplaatsingen worden gebruikt om bepaalde mechanische eigenschappen van een materiaal te bepalen. Wat betreft de cel kan je dan denken aan statisch oprekken en duwen, maar ook meer dynamisch, waarmee je inzicht krijgt in de visco-elasticiteit. “Daarbij wil je ook een beeld krijgen van de activiteit van de spiercellen. Dan kan door het aankleuren van de cellen. Via het confocale deel, dat door Confocal.nl zal worden geïntegreerd met de indentatie-apparatuur, kan je dit actieve proces volgen. Nog een stap verder is om het systeem uitgebreider te karakteriseren, zodat je ook veranderingen in de contractiliteit van die cel kan meten. De eigen bijdrage in de kracht kan je dan scheiden van de opgelegde, externe kracht”, legt Koen uit.
In het onderzoeksmodel van het Cellsystemics-project worden alleen humane cellen gebruikt. Hierbij wordt door een slim opgezette werkwijze een soort van patiëntspecifieke interne controle gerealiseerd, wat statistisch-methodologisch de nodige voordelen heeft. Je bent namelijk veel minder afhankelijk van de samenstelling van de populatie. Koen Reesink legt uit hoe dat in zijn werk gaat. “In het project onderzoeken we uiteraard de gladde spiercellen uit ziek weefsel, van met name de vergrote aorta’s van aneurysma patiënten. Maar we isoleren uit het bloed van diezelfde patiënten ook naïeve gladde spiercellen. Die kunnen we op een bepaalde manier plaatsen in het aangetaste weefsel, waarbij je op basis van verschillen in de dynamiek van het cellulaire systeem tussen deze celpopulaties een stapsgewijze reconstructie van de ziektegeschiedenis van de individuele patiënt kan maken. Voordeel van deze benadering is dat je ook de eventuele genetische afwijking meeneemt die ten grondslag ligt aan het ontstaan van een aneurysma. Je verkrijgt dus binnenin de patiënt naast de nieuwe meting ook een controlemeting van de ziekte.”
Koen heeft in de literatuur een zestal regelmechanismen gevonden, die aan de orde kunnen zijn bij het in stand houden van de elasticiteit van de vaatwand. De eenvoudigste is een korte-termijn reactie op uitrekken. Een cel kan ook extern worden gestimuleerd, wat te maken heeft met het calcium-gehalte en het samentrekken van de spiereenheden. Bij heel langzaam oprekken van de cel (30 minuten tot een paar uur) kan de cel intern zijn structuur veranderen, zodat die twee hiervoor genoemde, meer korte-termijn regelingen niet hoeven plaats te vinden. De cel kan ook besluiten om tot een andere ‘attitude’, de aanduiding van Koen voor een ander fenotype, te komen: ga ik trekken (contractiel zijn) of ga ik iets maken waardoor ik minder hoef te trekken? Tenslotte zijn er nog de interacties met de matrix en wat de cellen onderling uitwisselen.
Deze regelingen vinden plaats op verschillende systeemniveaus. Ook zijn ze niet onafhankelijk van elkaar; ze grijpen deels op elkaar in. “Zolang als een cel die regelmechanismen effectief kan inzetten, is er niets aan de hand. Als de cel door bijvoorbeeld inflammatie of andere processen dit niet meer goed kan doen, of er zelfs door wordt tegengehouden, dan kan hij niet meer adequaat reageren, wat een bepaalde impact op de wisselwerking met het cel-matrix netwerk heeft. Dat kan de trigger zijn naar het proces van het verstijven of excessief uitrekken van de bloedvatwand”, postuleert Koen.
In dat verhaal kan je de cel niet los zien van zijn omgeving. “We kijken dus niet alleen naar de cel, maar ook naar zijn omgeving. Dat zijn vanzelfsprekend de buurcellen, maar ook allerlei ‘niet-levende’ matrix componenten in de vaatwand. Gladde spiercellen zijn heel erg variabel, en het is natuurlijk dat ze allemaal verschillend reageren. Het gedrag van één zo’n cel is niet superingewikkeld, maar in een populatie met vele, zich verschillend gedragende cellen, krijg je een heel complex gedrag. Om inzicht in dat systeemgedrag te krijgen, om die dynamica te kunnen kwantificeren en karakteriseren, moet je niet heel precies inzoomen op één cel, maar is het zaak om zo goed mogelijk de heterogeniteit te pakken. Dit zowel meettechnisch als qua data-integratie en modelleren. Een verschuiving in het gedrag van de populatie zegt dan meer dan toevallig die ene cel die er om wat voor reden dan ook geen zin meer in heeft.”
De insteek in de analyse van Koen komt niet uit de lucht vallen. Opgeleid als elektrotechnisch ingenieur aan de TU/e kijkt hij met een andere blik naar cellen als de gemiddelde bioloog of biochemicus. Binnen zijn onderzoek bij Biomedical Engineering aan structurele en systeemeigenschappen van grote bloedvaten, dat deel uitmaakt van het CARIM-programma cardiovasculaire systeemdynamica, gebruikt hij bijvoorbeeld ultrasone technieken om de pathofysiologie achter stijfheid van arteriën in kaart te brengen. “Je ziet hiermee dat de wanden van de bloedvaten stijver worden bij ouder worden. Dat kan gebeuren door onderliggende (genetische) ziektes en/of ouderdomsgerelateerde processen. Maar daarmee weet je nog niet waarom het gebeurt. En –misschien nog wel belangrijker– hoe dat weefsel dan zo lang wèl goed kan worden gehouden. Als ingenieur zoek ik de oorzaak niet primair in de (biologische) processen in de cel, maar systemischer, waarbij ik de cel beschouw als iets dat kan voelen en iets dat een actie kan uitvoeren. De hoofdmoot van de arteriën wordt gevormd door gladde spiercellen. Die spelen volgens mij dan ook de hoofdrol in het gezond houden van het weefsel.”
Alles in één meetsysteem
Interne controle
Humane meetmodellen
Zes regelmechanismen
Cellulaire systeemdynamica
Gladde spiercellen
Om die theorie aan te tonen, en vooral ook meer inzicht te krijgen in het verloop van een ziekte, van een gezonde naar een ongezonde toestand, is een platform nodig dat door integratie van biologische en mechanische metingen een veel uitgebreidere karakterisering van de cellen mogelijk maakt. En dan niet per se de individuele cellen, maar de cellen als onderdeel van een systeem.
De ontwikkeling van dat platform is één van de doelen van het Cellsystemics-project. Dit project is onderdeel van het onderzoeksprogramma Humane Meetmodellen, dat wordt gefinancierd door Samenwerkende Gezondheidsfondsen (SGF), Health Holland, NWO en ZonMW. Ambitie van dit programma is om de transitie naar proefdiervrije innovaties te versnellen. Hierin sluit het aan bij Transitie Proefdiervrije Innovatie (TPI), waar onder andere SGF partner van is.
Cardiovasculaire ziektes vormen wereldwijd gezien de belangrijkste oorzaak van vroegtijdig overlijden. Er wordt dan ook enorm veel onderzoek naar gedaan, van fundamenteel tot klinisch. “Maar”, stelt Koen Reesink, “we missen nog een belangrijk stuk fundamentele kennis. Dat heeft vooral te maken met de link tussen mechanica en het biologische deel; die is nog niet goed gelegd. Biologen en biochemici –als ik dat zo mag generaliseren– kijken vooral met een biologisch oog naar cellen; gebruiken biologische en biochemische parameters om hun observaties te duiden. Maar een cel interacteert ook op andere manieren met zijn omgeving. Hij wordt geduwd, er wordt aan hem getrokken, en hij deelt zelf ook wel eens uit. Die mechanische aspecten zijn –zeker op systeemniveau– nog onderbelicht. Laat staan dat ze met onze biologische kennis op dit gebied in een totaalplaatje zijn geïntegreerd.”

