nieuwe apparatuur
Sinds ruim een jaar heeft de Flow Cytometrie Unit (FCU) van het UMCG twee NovoCyte Quanteon flowcytometers in gebruik. Met deze apparaten kan de bulk van het flowcytometrische werk worden afgehandeld. Vanwege de gebruiksvriendelijkheid van deze apparatuur hoeft Geert Mesander, die als operator aan de FCU is verbonden, minder dan voorheen aandacht te besteden aan het inwerken van nieuwe gebruikers. Aan zijn expertise op het gebied van het opzetten en uitwerken van de metingen blijft wel veel behoefte.
Groningse
flowcytometrie-unit
investeert in
Geert Mesander is al ruim 30 jaar als operator verbonden aan de Flow Cytometrie Unit (FCU) van het UMCG. Daar zijn sinds een klein jaar twee NovoCyte Quanteon flowcytometers in gebruik.

BioSPX en flowcytometrie
De Quanteon flowcytometers zijn ontwikkeld door ACEA Biosciences, dat sinds 2018 onderdeel is van Agilent. Ze worden sinds begin 2021 in Nederland op de markt gebracht en geserviced door BioSPX. De flowcytometers zijn relatief nieuw in het BioSPX-pakket. Dit hangt samen met een andere overname door Agilent, eind 2020, van BioTek. Dit Amerikaanse bedrijf wordt al lange tijd door BioSPX vertegenwoordigd. BioTek is sterk in allerhande imaging-systemen en richt zich daarmee op soortgelijke doelgroepen als die voor flowcytometrie. Dat maakt het logisch om het productenpakket van beide Agilent-onderdelen onder te brengen bij een en dezelfde leverancier: BioSPX.
Bij flowcytometrie worden cellen in suspensie hydrodynamisch gefocust. Je creëert hiervoor een vloeistofstroom waarbij de cellen gedwongen worden om naar het midden van de vloeistofstroom te gaan. Dat wordt zover doorgevoerd dat er op den duur nog maar één cel door kan, en de laser dus alle cellen netjes op een rijtje langs ziet komen.
De laser is zo gepositioneerd dat de cellen precies door de laserspot heengaan. Die spot is zo gefocust dat alleen het gebiedje waar die ene cel langskomt wordt aangestraald. Je meet twee soorten signalen: fluorescentie en lichtverstrooiing. Het fluorescentiesignaal wordt opgevangen door een lens achter de straal te plaatsen, die het licht verdeelt naar de verschillende detectoren, die specifieke golflengtes (kleurtjes) meten van één of meer fluoroforen die zijn gekoppeld aan bijvoorbeeld bepaalde typen cellen of eiwitten.
De lichtverstrooiing is er in twee smaken. De signalen die in een hoek van 90° ten opzichte van de laser worden opgevangen (side-scatter) vertellen iets over de complexiteit van onderdelen van de cel, zoals de kern en vesicles in het cytoplasma (bijvoorbeeld granulocyten hebben in tegenstelling tot monocyten of lymfocyten een gelobde kern, wat tot extra side-scatter leidt). Uit signalen in het verlengde van de laser (forward scatter) is informatie te halen over de grootte van de cellen.
De scatter gebruik je vooral om je doelpopulatie te analyseren. In een monster zitten altijd veel kleine celfragmenten van dode cellen. Op basis van de scattersignalen kan je deze debris er softwarematig uithalen. Dat kan ook om dode van levende cellen te onderscheiden, wat belangrijk is omdat dode cellen het signaal behoorlijk kunnen verstoren.
Werkingsprincipe flowcytometrie
Fysiek sorteren van cellen
De sorteersystemen bij de FCU zijn gebaseerd op een vloeistofstraal die in trilling wordt gebracht, zodat er druppels ontstaan. Als dat druppeltje vervolgens door een elektrisch veld gaat, krijgt het een elektrische lading, zodat de baan van het druppeltje wordt afgebogen.
De beslissing van welke druppel wel en welke niet wordt geselecteerd gebeurt daarvoor al. Net als bij een flowcytometer gaan de cellen door een laserspot en zullen bepaalde kleuren (golflengtes van fluoroforen) worden gedetecteerd. Als je bijvoorbeeld in de software hebt aangegeven dat de groene cellen in een apart buisje moeten worden opgevangen, beslist de elektronica direct tijdens het meten bij een groene cel dat die zal worden gesorteerd. Op dat moment is de vloeistofstraal nog in beweging; ter hoogte van de laser zijn er nog geen druppels. Die worden gevormd in een snel heen en weer trillende nozzle. Wanneer de groene cel daar is gearriveerd krijgt de vloeistof heel even een lading, zodat juist dat ene druppeltje met de groene cel wordt afgebogen.
Dit proces, dat vergelijkbaar is met dat van inkjetprinter, gebeurt met de moderne apparatuur met een snelheid van tienduizenden cellen per seconde.
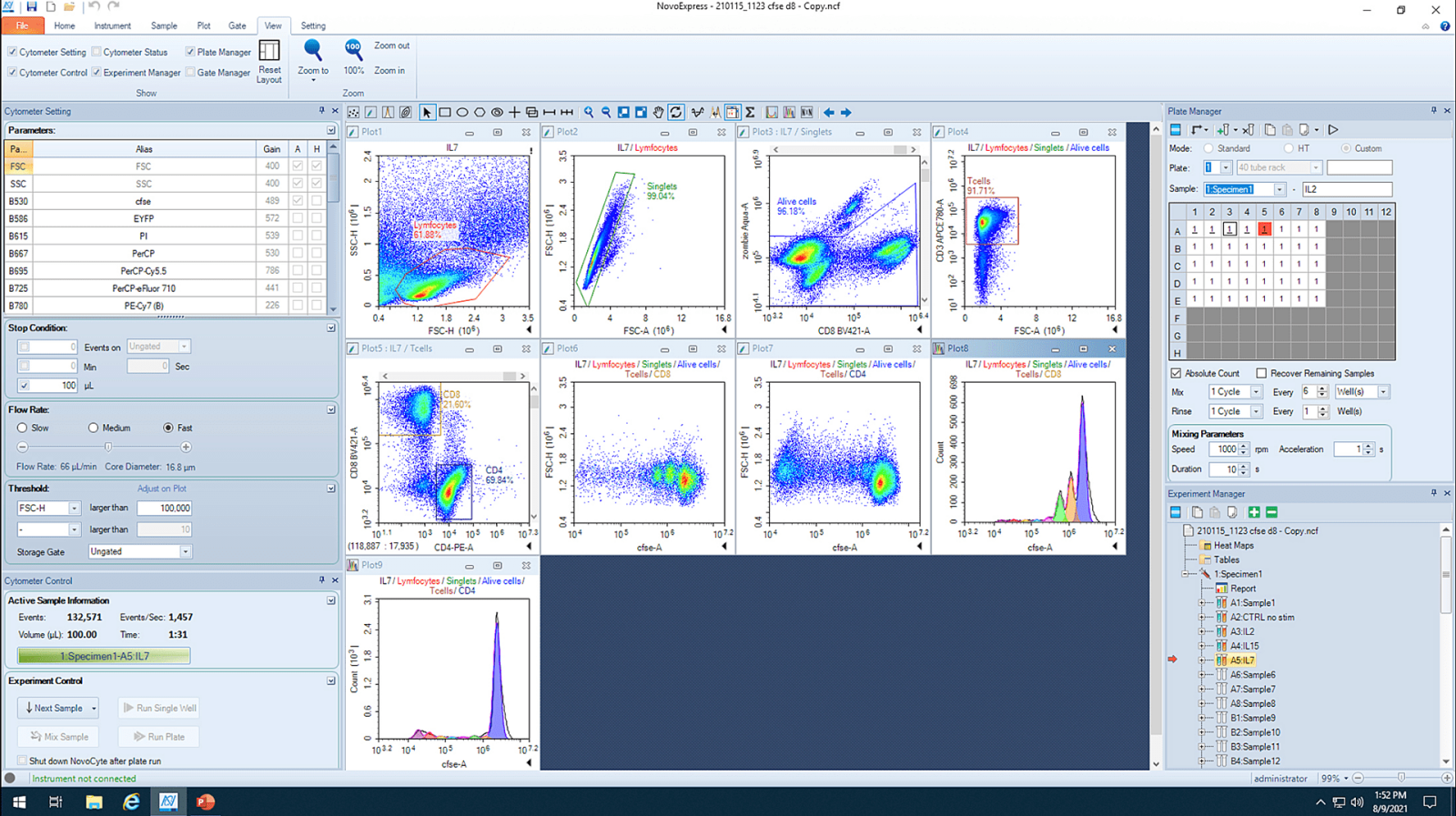
Analyse van een experiment waarbij gekeken wordt naar de activatie met IL-7 op verschillende soorten T-cellen (CD4 en CD8). De cellen zijn gelabeld met CFSE die laat zien hoe vaak de cellen hebben gedeeld (bij elke celdeling halveert de fluorescentie-intensiteit).
De Quanteon flowcytometer is uitgerust met een plateloader, die het mogelijk maakt om vanuit een 96-wells plaat of een monsterrek met plek voor 40 buizen geautomatiseerd te meten.

Door de grotere gevoeligheid van de moderne instrumenten kan je niet alleen veel preciezer met zwakke signalen uit de voeten, maar kan je ook kijken naar kleinere deeltjes. Daarvan wordt de laatste tijd geprofiteerd voor onderzoek naar extracellulaire vesicles, hele kleine deeltjes in de cellen, die je met de moderne apparatuur kan analyseren en sorteren.
Een tool die steeds vaker wordt ingezet bij de analyse is softwarematige clusteranalyse. Dat zit feitelijk in het verlengde van het zo goed mogelijk uit elkaar pluizen van de signalen. Met behulp van clusteranalyse kan je dan relatief eenvoudig alle populaties eruit halen. “Daar wordt de onderzoeker enorm mee geholpen. Vroeger had je twee of drie kleuren, en was het heel simpel. Vanaf tien kleuren wordt het al een stuk ingewikkelder om alles te analyseren en is er een steeds grotere kans dat je dingen gaat missen omdat je er niet gericht naar kijkt. Ook handig is dat je met de software verschillende profielen naast elkaar kan zetten, bijvoorbeeld van een meting van antigenen (eiwitten) en van mRNA. In die meer ingewikkelde analyses zit de toekomst. Daar helpen we de onderzoekers met onze mix van state-of-the-art apparatuur en praktische ervaring graag bij!”
Clusteranalyse

De bediening is zo uitgelegd, waarna de gebruiker met enige hulp een testprotocol kan maken

Via de plateloader kan je vanuit een 96-wells plaat of een monsterrek met plek voor 40 buizen geautomatiseerd meten. Hierbij moet je in de software op het apparaat een meetprotocol aanmaken, waarbij je van tevoren aangeeft in welke posities de monsters zitten en hoeveel cellen je wilt tellen per volume-eenheid. “Bij veel andere standaard flowcytometers moet je allerlei trucs uithalen om er achter te komen hoeveel cellen er per volume-eenheid in je buisje zaten. Bij de Quanteon werkt dat veel directer. Een soort van zuigersysteem zuigt precies bijvoorbeeld 100 µl van je monster op. En dat wordt geanalyseerd. Dus je weet: alles wat ik nu tel, zit in die 100 µl.”
Wat gevoeligheid en meetbereik betreft zit je voor het gros van de standaard toepassingen bij de Quanteon wel goed. “Met een dynamisch bereik van meer dan zeven decades kan je in bijna alle gevallen met één setting werken. Het afgelopen jaar hebben we een paar keer de setting moeten aanpassen omdat cellen heel sterk fluoresceerden en daardoor net buiten het meetbereik vielen. Maar verder gaat alles heel soepel, wat wel ook verklaart dat iedereen er mee wil werken. Gelukkig hebben we er twee van staan!”
Deze flowcytometers hebben vier lasers en 21 kanalen. “Het zal bij ons niet gebeuren dat er 21 kleuren op deze apparaten zullen worden gemeten. Het wordt dan veel te lastig om de signalen softwarematig uit elkaar te trekken; er zit teveel overlap tussen. Experimenten met acht tot tien kleuren kan je er prima op draaien. Voor meer kleuren verwijzen we de onderzoekers door naar instrumenten met meer lasers. In veel gevallen is dat de Aurora, een spectrumanalyzer met 64 kanalen, die exclusief voor researchmetingen is bedoeld.”
Voordeel van de nieuwe flowcytometers is dat ze vergezeld gaan van gebruikersvriendelijke software, die de bediening van het instrument relatief eenvoudig maakt. Zo ook bij de Quanteon. “Wij kennen sowieso alle mogelijkheden van de software, maar die uitgebreide kennis hoeft de doorsnee gebruiker niet te hebben. De bediening is zo uitgelegd, waarna de gebruiker met enige hulp een testprotocol kan maken. Als ze wat meer ervaring hebben, kunnen ze dat zelfstandig. Daarna worden we er ook nog wel eens bij geroepen, vooral voor technische troubleshooting. Ze zien geen cellen langskomen, of er komt een heel vreemd plaatje uit de resultaten. Meestal zien we dan snel wat er mis is gegaan en kunnen we dat oplossen.”
Het beleid vanuit de universiteit en het ziekenhuis is dat de FCU als Groningse ‘place to be’ voor flowcytometrie eerste keus is als het aankomt op investeringen voor flowcytometers. Dat betekent dat andere afdelingen hiervoor geen aanspraak kunnen maken op het investeringsbudget van de RUG of het UMCG. Mede daardoor is er de laatste jaren veel geïnvesteerd in nieuwe apparatuur. Naast de Cytek Aurora en Symphony A50, die bedoeld zijn voor sophisticated onderzoekstoepassingen, zijn dat twee NovoCyte Quanteon flowcytometers voor meer eenvoudige toepassingen, de bulk van het meetwerk bij de FCU. Voor dit jaar staat nog een nieuwe sorteermachine gepland. “Als we die binnen hebben zijn we voor nu up-to-date’, aldus Geert Mesander.
Anno nu is flowcytometrie behoorlijk ingeburgerd en is de FCU navenant gegroeid. Naast Geert werken er nog twee operators en een manager. Jaarlijks maken tussen de twee- en driehonderd onderzoekers (PhD’s, postdocs, analisten, studenten) van naburige afdelingen als stamcelbiologie, hematologie, oncologie, immunologie, reumatologie en celbiologie gebruik van één van de momenteel zeven flowcytometers. Dat inmiddels vrij stabiele aantal gebruikers wordt ieder jaar ten gevolge van de ‘onderzoeksdynamiek’ ververst met zo’n vijftig nieuwe. Die nieuwe gebruikers moeten op de website van de FCU een registratieformulier invullen, waarin ze ook aangeven wat ze willen gaan doen. “Wij kunnen dan adviseren op welk apparaat ze het beste kunnen meten. Ook maken we ze wegwijs bij de bediening van het apparaat en het werken met de software.”
Andere taken van Geert en zijn collega’s liggen op het gebied van onderhoud en troubleshooting. “Omdat we ons fulltime bezighouden met flowcytometrie kunnen we altijd hoogwaardige ondersteuning bieden; we kennen alle technische ins-and-outs van de apparaten, en kunnen derhalve veel storingen zelf oplossen. Dat werkt ook door in de kosten die we intern doorberekenen. Die zijn relatief laag omdat we ze over zo’n grote pool aan gebruikers kunnen verdelen.”
Meten in platen
Breed meetbereik
De juiste kleuren
Eenvoudige bediening
Investeren
Hot spot
De ervaring van de operators komt vooral tot zijn recht bij het leggen van de koppeling tussen het ontwerp van een experiment en de meetbaarheid. “Tegenwoordig draaien onderzoekers de hand niet meer om voor experimenten met wel tien verschillende antilichamen. Die kan je allemaal een eigen kleurtje geven. Maar je moet er daarbij wel rekening mee houden dat je die kleuren op het apparaat goed van elkaar kunt scheiden. Daarvoor zijn de golflengtes van de lasers en de gevoeligheid van de detectoren bepalend. Iets wat voor elk van de flowcytometers binnen ons instrumentenpark verschillend is. Op internet kan je hele mooi tabelletjes vinden van ideale combinaties, maar de praktijk blijkt daarin nogal eens weerbarstig. De ene flowcytometer is de andere niet; het is zaak om het instrument te kiezen dat het beste past bij je experimentele eisen.”
Ingewikkelde, grote apparaten met heel veel knoppen om aan te draaien en desalniettemin maar beperkte mogelijkheden. Dat was de ‘laatste stand der techniek’ waarmee Geert Mesander zo’n 30 jaar geleden als operator aan de slag ging bij de enkele jaren eerder, in 1991, door een aantal Groningse onderzoeksgroepen opgerichte Flow Cytometrie Unit (FCU). “We hadden toen twee flowcytometers. De ene werkte met één laser en kon drie kleuren meten. De andere was het researchinstrument, want die had twee lasers en kon ook nog eens een extra fluorescentiesignaal detecteren. Onderzoekers moesten toen nog wel even geduld hebben voordat ze konden meten, want met de twee verschillende lasers was ik zo een uur zoet om die signalen zo goed mogelijk te krijgen. Het was toen echt specialistenwerk. Daar had ik –als toen nog enige operator– ook de tijd voor, want het aantal gebruikers was nog vrij beperkt; het was echt nog een opkomende techniek.”

