verdedigingslinie van
kinderhersentumorcellen
Dennis Metselaar heeft tijdens zijn onlangs afgesloten promotie-onderzoek bij de Hulleman groep van het Prinses Máxima Centrum voor Kinderoncologie honderden, zo niet duizenden cell-repellent platen gebruikt. Met name voor omvangrijke drugscreens op cellijnen van kinderhersentumoren en knockout-experimenten met wel 5.500 CRISPR-constructen. Hiermee heeft hij munitie verzameld om de verdedigingslinie te slechten van deze meester-overlevers. Dat biedt perspectief voor de alleen al in Nederland tientallen jonge kinderen die jaarlijks overlijden aan niet of nauwelijks te behandelen hersentumoren.
Scheurtjes in
Post-doc Dennis Metselaar heeft tijdens zijn onlangs afgesloten promotie-onderzoek bij de Hulleman groep van het Prinses Máxima Centrum voor Kinderoncologie honderden, zo niet duizenden cell-repellent platen van Greiner Bio-One gebruikt.


“Kindertumorcellen hebben veel weg van stamcellen, wat je onder andere terugziet in hun ‘self renewal’ capaciteit.


Lees hier meer over
de cell-repellent producten van Greiner.
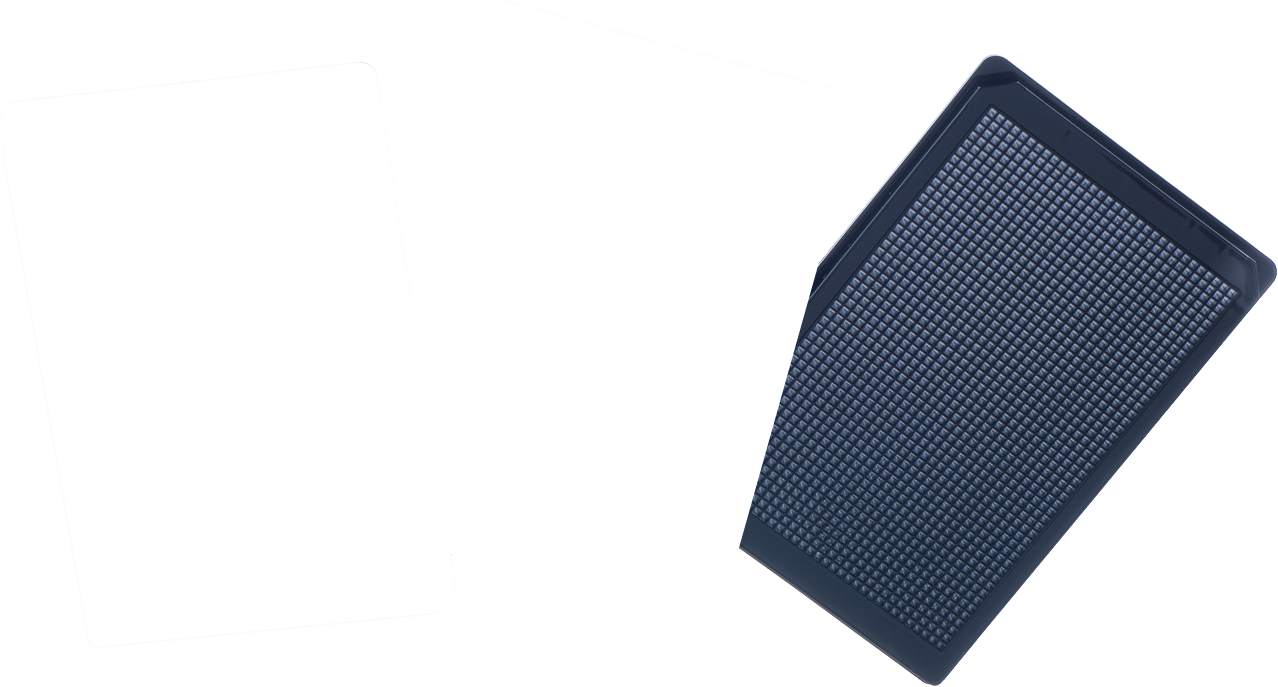


De zwarte CELLSTAR cell-repellent platen van Greiner Bio-One hebben een transparante bodem. Dit maakt ze geschikt om vanaf de onderkant met een fluorescentiemicroscoop de met immunofluoforen gekleurde cellen te volgen in migratie-experimenten. Omdat de buitenring van deze platen lager is dan bij andere merken en er ook dunner kunststof wordt gebruikt, kunnen de cellen ook bij grote vergrotingen goed in focus worden gebracht.
Slimme combinatietherapieën
Het promotie-onderzoek van Dennis Metselaar, waarin hij samenwerkte met een team van analisten, een zestal studenten dat hij begeleidde en collega-promovendi, leverde verschillende (ingangen voor) potentiële geneesmiddelen. We lichten er twee uit.
Celasterol, een extract uit de ‘thundergod vine’, dat al duizenden jaren wordt gebruikt in de traditionele oosterse heelkunde, blijkt het FANCD2-eiwit uit te schakelen. Dit eiwit speelt een rol in het Fanconi-mechanisme, dat verantwoordelijk is voor het repareren van DNA-schade. In combinatie met carboplatin, dat zorgt voor crosslinking in delende cellen, leidt dat tot een enorme accumulatie van DNA-schade in HGGs en gaan ze dood. Bij de CRISPR-screening van 600 verschillende kinases op DIPG-specifieke letaliteit sprong Aurora Kinase eruit. Lees meer over dit onderzoek.
Vervolgexperimenten leidden tot een effectief combinatie-effect van een Aurora Kinase-inhibitor en PLK1-inhibitie. Zowel Aurora Kinase als PLK1 hebben een rol bij het correct maken van de spoel bij het repliceren van DNA. Combinatiebehandeling zorgt ervoor dat de DIPG-cellen in hun G2-cyclefase vast komen te zitten. Dan hebben ze geen toegang meer tot de G1-fase, waar ze nog allerhande repair-mechanismen kunnen gebruiken.
Het kweken van 3D-tumoroids van kinderhersencellen gaat prima in standaard kweekflessen. Wat betreft de platen voor de assays komt dat een stuk nauwer; daarvoor zijn alleen de cell-repellent platen van Greiner Bio-One geschikt.
Om iets zinnigs uit die enorme DNA-brij te kunnen halen zit op het ingebouwde stukje DNA ook een ‘barcode’. “Die kunnen we met bepaalde primers herkennen en amplificeren we. De rest van het DNA gaat weg en het geamplificeerde DNA sturen we op voor sequencing. Dat wordt heel diep gesequenced, wel miljoenen keren, en op een zeker moment kunnen we op de computer zien welke genetische codes het vaakst voorkomen, en kunnen we de verhoudingen daartussen meten. Dus als de cellen met construct A, dat door een virus is ingebracht, drie keer zo hard zijn gaan groeien door hun knock-out, dan zullen we die code drie keer zo vaak terugvinden ten opzichte van cellen die niet harder zijn gaan groeien, de controlecellen. Omdat je dat met 5.500 tegelijk doet, krijg je een soort van panel, waar je de harde en langzame groeiers uit kan halen.”
Het eigenlijke experiment is de uitvoering van dit hele proces parallel met een daaraan toegevoegd beoogd medicijn, zodat je de effecten daarvan in kaart kan brengen. “We zijn dan op zoek naar de knock-outs die in de niet-behandelde cellen geen effect geven, want waarschijnlijk zal die knock-out in gezonde cellen ook weinig effect hebben. En dan hopen we dat in de behandelde CRISPR-screening dezelfde gen-knock-out celdood veroorzaakt. ‘Dan heb je een gen gevonden dat, wanneer we het zouden onderdrukken in de tumor, de behandeling van het medicijn versterkt. En dan zou je dus een combinatie van twee geneesmiddelen daartegen kunnen gebruiken, en heb je weer wat munitie om een deel van de verdedigingsmuur te slechten!”
Dennis voerde in de eerste jaren van zijn promotie-onderzoek vooral drugscreens op de cellijnen uit. In de loop van de tijd is de focus verschoven naar onderzoeken van het effect van het met behulp van CRISPR-Cas9 op grote schaal aanbrengen van genetische modificaties in de tumorcellen. “De ‘klassieke’ werkwijze met het Cas9-enzym is dat het een via een virus ingebracht actief stukje DNA herkent, dat altijd wordt afgeschreven. Het afschrift ervan is complementair aan het gen dat we eruit willen hebben. Cas9, herkent dat en zegt: knip. Dat gebeurt keer op keer, iedere seconde, totdat er na een aantal cycli (dat kunnen er duizenden zijn) een frame-shift plaatsvindt, waardoor het DNA niet meer goed kan worden afgelezen op die plek en er een knock-out van het gen is ontstaan”, vertelt Dennis.
“Wij doen dit kniptrucje op grote schaal met een verzameling van 5.500 CRISPR-constructen tegen elk gen waarin we geïnteresseerd zijn. Dat betekent dat je even zoveel verschillende virussen maakt. Die stop je allemaal bij elkaar in één pool. Die miljarden virussen (elk van de 5.500 in dezelfde ratio) gooien we op miljoenen cellen. Naar ratio zullen die ook de cellen infecteren. We zorgen hierbij voor een zodanige verhouding tussen virussen en cellen dat er gemiddeld één virusinfectie per cel is. Vervolgens behandelen we de cellen met een soort van antibioticum dat normaal cellen doodt. Maar in de CRISPR-constructen zit ook een resistentiegen tegen dat antibioticum. Dus alleen de cellen, die niet door een virus zijn geïnfecteerd, gaan dood. Daarna activeren we Cas9 (in de overgebleven cellen) voor het knipwerk en kunnen we de cellen selecteren die een frame-shift hebben. Die kweken we op en geven we een bepaalde behandeling. Op dag 7, 14 en 21 nemen we een paar miljoen cellen uit de fles en isoleren al het DNA dat erin zit”, legt de onderzoeker uit.
Het is niet alleen lastig om de tumorcellen in vivo uit te schakelen, maar ook om ze in vitro geschikt te houden voor experimenten. “De afgelopen jaren hebben we veel aan drug screening gedaan, waarbij we bibliotheken van honderden medicijnen op DIPG- en HGG-modellen hebben getest. Onze DIPG-modellen, zo’n 30 kweeklijnen, komen uit tumorweefsel van pas overleden patiëntjes, dat we via een bij het VUmc heel zorgvuldig opgezet autopsieprotocol hebben verkregen. Voor de glioblastomen konden we toe met tumorweefsel van biopten of chirurgische resectie. Vaak groeien de delen aan de rand van een tumor het beste, want ze hebben in het brein al een proces doorgemaakt dat ze ergens anders heen willen groeien. De fijnste modellen zijn de langzaam groeiende, die eenmaal aangepast aan het kweekmedium door blijven groeien. Snelgroeiers houden er soms al na een paar cycli mee op.” Daarbij is het ook belangrijk om de cellen te kweken op een zo realistisch mogelijke manier. “In het verleden werden cellen in standaard medium gebracht met veelal uit koeienserum gewonnen groeifactoren om ze lekker snel te laten groeien. Daardoor gingen ze echter differentiëren. Ze werden feitelijk volwassen, zodat je een cellijn kreeg die helemaal niet meer leek op de originele tumorcellen”, vertelt Dennis.
“Zeker bij kindertumoren is het essentieel dat we die stamceleigenschappen in stand houden, omdat daarin de sleutel naar hun succesvolle verdediging zit”, vervolgt hij. “Daarom is het zaak om onze tumorcellen te kweken in een omgeving met goed gereguleerde groeifactoren. En ze kweken in de vorm van tumoroids, driedimensionale balletjes van tumorcellen. Een dergelijk construct lijkt meer op een tumor; het heeft een buiten- en een binnenkant, die wat minder zuurstof heeft en meer necrotisch wordt, zoals je dat ook in het brein ziet.”
Mocht je uiteindelijk een target hebben gevonden, dan laten de tumorcellen zich niet gemakkelijk verschalken. “Sowieso verschuilen ze zich achter de bloedhersenbarrière, die voor 98% van de chemische verbindingen potdicht blijft en voor de rest alleen bij hoge, vaak toxische concentraties, iets laat doorsijpelen. Bij het Prinses Máxima Centrum wordt gewerkt aan sonoporatie, een techniek om via geluidsgolven ter hoogte van de plek van de tumor het binnenepitheel van de bloedvaten zodanig aan het trillen te brengen dat de tight-junctons tijdelijk opengaan. Deze techniek staat echter nog in de kinderschoenen.”
Ben je die barrière over dan hebben de tumorcellen zelf ook nog wel het één en ander in huis om het de tegenstander moeilijk te maken. “Kindertumorcellen hebben veel weg van stamcellen, wat je onder andere terugziet in hun ‘self renewal’ capaciteit. Je kunt ze met één medicijn wel vloeren, maar voor echt uitschakelen is een combinatietherapie nodig. Deze stamcelachtige flexibiliteit vind je ook terug in hun vluchtgedrag voor bestraling. Dat vinden de tumorcellen niet leuk, waarop ze een zogenaamde epitheliale mesenchymale transitie ondergaan. Ze stoppen met delen en leggen al hun energie in het migreren vanaf de bestraalde plek. Ietsje verderop schakelen ze weer terug naar delen”, legt Dennis uit.
Tenslotte zijn hersentumoren ook enorm ‘immuno-cold’: er zijn nauwelijks immuuncellen aanwezig. Sterker, hersentumoren zorgen er op de een of andere manier voor dat witte bloedcellen, juist de cellen die kankercellen aanvallen, niet meer in het brein kunnen komen. Dat maakt dat immuuntherapie, waarbij witte bloedcellen worden getriggerd om aan te vallen, bij hersentumoren tot nu toe niet succesvol is geweest.
Als je de ontwikkeling van een medicijn tegen HGG en DIPG als een wedstrijd ziet, moet je wel beseffen dat je deze begint met een flinke achterstand. Dennis Metselaar, die tijdens zijn promotie-onderzoek bij de groep van Esther Hulleman (tot twee jaar geleden verbonden aan het VU medisch centrum; sindsdien bij het Prinses Máxima Centrum) aardig wat punten heeft gescoord, kan zo vijf vervelende eigenschappen van kinderhersentumoren noemen waar onderzoekers mee moeten dealen. “De kiem hiervoor wordt gelegd tijdens de embryogenese: het zijn echte ontwikkelingsziektes. De tumoren zijn epigenetisch gedereguleerd, waarbij er sprake is van twee specifieke histon-3 mutaties die zijn gecorreleerd met de plek waar de tumoren later opduiken; de ene in de hersenstam en de andere juist daarbuiten. Histonen zijn grote eiwitcomplexen waar het DNA omheen is gewikkeld. Zit het er strak omheen, dan is er geen transcriptie; is het wat losser, dan worden de genen van het betreffende stukje DNA actief. In het geval van de mutatie ontstaat er een zodanige verwarring bij de complexen die op de histonen zitten, dat de omwikkeling van het DNA wordt verstoord. Dat heeft impact op de expressie van wel honderden genen, en dat maakt het zoeken naar een medicijn heel ingewikkeld. Heel anders dan bij volwassen tumoren, waarbij we vaak een paar hele duidelijke mutaties kunnen associëren met kanker, en je medicijnen kunt ontwikkelen die werken tegen die specifieke mutaties. In ons geval draait het om tumoren met honderden genen, die te laag of te hoog tot expressie worden gebracht.”
Deep sequencen
Het betere knipwerk
Cell-repellent platen
Lastig kweken
Sterke verdediging
5-0 achter
Waar het vormen van die balletjes prima gaat in standaard kweekflessen –bij het Prinses Máxima Centrum gebruiken ze de Greiner-kweekflessen met de rode dop–, komt dat wat betreft de platen voor de assays een stuk nauwer. “Als je standaard platen gebruikt, gaan de cellen hechten. Dan gaan ze ook een bepaalde transitie door, worden ze volwassen en behouden ze niet die typische stamcelkarakteteristieken. Ze lijken daardoor minder goed op de cellen in het brein. Met de cell-repellent platen van Greiner Bio-One heb je daar geen last van. We gebruiken hiervan vooral de 96-well’s platen. Bij de 384-well’s zijn de ruimtes een stuk kleiner en gaan de cellen zich anders gedragen”, aldus Dennis Metselaar, die sinds augustus als post-doc werkt bij de Hulleman-groep.
De meest agressieve soorten hersentumoren bij kinderen zijn hooggradige gliomen (HGGs) en een subklasse daarvan, de hersenstamtumoren, oftewel diffuse intrinsieke ponsgliomen (DIPGs). Met name de DIPGs bieden momenteel geen overlevingskans voor de circa tien kinderen van gemiddeld zes jaar oud die in Nederland hiermee worden gediagnosticeerd. Deze tumoren zitten diep verweven in de onderkant van het brein, waardoor ze niet operabel zijn en bestraling, ofschoon het wel leidt tot een tijdelijke vermindering van de symptomen, niet curatief is. Daarbij zijn ze ook nog eens heel ongevoelig voor chemotherapie. Dat laatste geldt ook voor de uit gliacellen ontstane snel delende HGGs, die bovendien een heel diffuus en agressief groeipatroon hebben. De tumor is niet één bol, maar een verzameling van door het brein verspreide celletjes. Dit maakt behandeling lastig, want je kunt niet gericht bestralen en je mist altijd wat cellen als je wegsnijdt. Toch geldt hier voor de jaarlijks circa 30 HGG-patiëntjes in Nederland een overlevingskans van zo’n 20%. Als de glioblastomen aan de rand van het brein zitten kunnen ze grotendeels door de chirurg worden weggehaald. Nabehandeling met straling en chemotherapie kan dan net de goede kant op vallen.

